Arbeitsgruppe Prof. Christian Mayer

Gepulste Feldgradienten-NMR (PFG-NMR)
Ein Schwerpunkt unserer aktuellen Forschung liegt im Bereich der Einkapselung von Wirkstoffen in polymere Nanokapseln. Solche Systeme, zu denen sowohl Nanosphären als auch Nanokapseln gehören, können beispielsweise als Träger pharmazeutischer Wirkstoffe oder von genetischem Material dienen.
Zur Charakterisierung von nanoskaligen Systemen nutzen wir die spezielle Methoden der Pulsed field gradient Kernresonanzspektroskopie (PFG NMR) , die vielfältige Informationen zur Struktur, Dynamik und zu den physikalisch-chemischen Eigenschaften kleiner Kapseln, Vesikel, Mikroemulsionen und auch lebender Zellen liefert.
Die Selbstdiffusion wie wir sie nutzen findet im flüssigen Medium immer statt. Wir betrachten nun eine Probe in der z.B. Nanopartikel oder eine Phasengrenze die Bewegung von Molekülen einschränken kann.
Vergrößern wir den blick in unserer Probe, so dass wir die Sonden-Moleküle in ihrer Bewegung sehen können, dann erkennen wir das bei einer kleinen Diffusionszeit keinen Unterschied in der zurückgelegten Wegstecke der freien und der gehinderten Sonden-Moleküle (a).
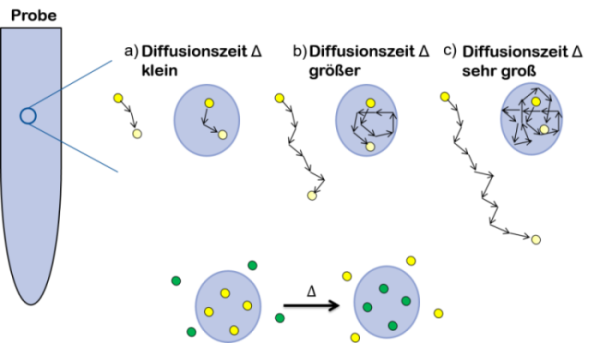
(b) + (c) Vergrößern wir die Diffusionszeit erkennen wir, das das eingekapselte Sonde-Molekül (Tracer-Molekül) durch die Kapselwand (die hier beispielhaft als „Barriere“ fungiert) an der freien Bewegung gehindert wird, das nicht eingekapselte Tracer-Molekül kann sich frei bewegen und entfernt sich weiter vom Ursprung als im Bild (a).
In der Realität sehen wir zusätzlich einen Austausch der Sonden-Moleküle während der Diffusionszeit durch die Kapselwand in die kontinuierliche Phase und umgekehrt.
Die folgende Abbildung zeigt das verwendete Pulsprogramm, welches auch Stimuliertes Echo (STE) genannt wird.
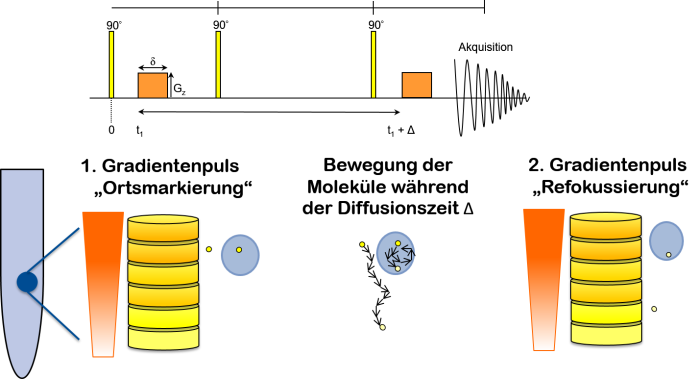
Das besondere in dieser Pulsfolge sind zum einen die beiden Gradientenpulse (orange) und zum anderen die beiden 90 Grad Pulse, die während der Diffusionszeit eingestrahlt werden. Sie verhindern die T2-Relaxation während der Diffusionszeit. Diese Pulsfolge eröffnet für uns ein Zeitfenster für die Diffusion von ca. 15 ms bis zu ca. 800 ms.
Der eingestrahlte Gradient wirkt wie eine Segmentierung der Probe in flache Scheiben mit unterschiedlichen Larmor-frequenzen, die eine Phasenverschiebung auf das Spin-System bewirken. Die Moleküle werden mit dem 1. Gradientenpuls „Ortsmakiert“, das heißt sie bekommen nach dem 90 Grad Puls eine eigene Phase abhängig von ihrem Aufenthaltsort in der Probe (dephasierung). Der 2. Gradientenpuls wirkt nach der Diffusionszeit Delta wieder auf das Spin-System. Jetzt wird eine ortsabhängige Phasenkorrektur vorgenommen (rephasierung). Je nach dem wie weit sich die Moleküle von ihrem Ursprung entfernt haben ist diese Phasenkorrektur mehr oder weniger wirksam.
[Erklärung]
- T2: Spin-Spin-Relax. (transversale R.) (Verteilung der Spins in der x/y-Ebene)
- T1: Spin-Gitter (longituginale R.) (Rückstellung zur z-Achse)
Durch die Bewegung der Moleküle während der Diffussionszeit Delta „passt“ die Phasenverschiebung der Moleküle nun nicht mehr zur Gradientenstärke am neuen Ort. Daraus resultieren je nach dem wie weit sich die Moleküle bewegen konnten verschieden starke Signale (Echo-Signale).
- Bewegt sich ein Molekül nicht sehr weit bzw. wird des durch die Kapselwand gehindert ergibt sich eine starkes Signal
- Umgekehrt erhalten wir ein schwaches Signal wenn das Molekül sich während der Diffusionszeit weit vom Ursprungsort entfernen konnte.

Im Verlauf eines Experimentes wird der eingestrahlte Gradient erhöht, dies bewirkt, dass die „Segmente“ gleicher Phase immer kleiner werden. Oder anders ausgedrückt, werden die unterschiede der Phasenverschiebung, die die Moleküle bei Bewegung erfahren immer größer. Je größer der Gradient ist, desto kleinere Bewegungen können mit dieser Methode beobachtet werden.
Die so gewonnenen experimentellen Daten werden in einem Stejskal-Tanner-Plot dargestellt. Diese Darstellung erlaubt uns weitere Möglichkeiten unsere Daten zu interpretieren.
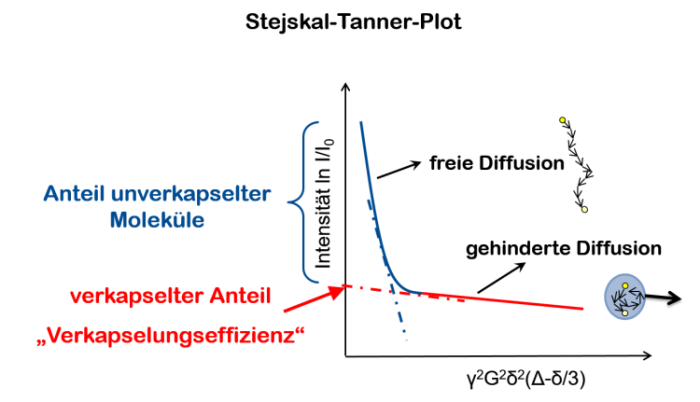
Durch die beiden Teile der zusammengesetzten Kurve kann jeweils eine Gerade gelegt werden, die Steigung der Geraden entspricht dem negativen Wert des Selbstdiffussionskoeffizienten der jeweiligen Fraktion. Der steil abfallende Teil wird der freien Diffusion zugeordnet und der flachere Teil der Kurve entspricht dem apparenten Diffusionskoeffizienten der eingekapselten Moleküle. Der schräge Verlauf der gehinderten Diffusion erklärt sich durch die Bewegung der Nanokapseln. Extrapoliert man die Gerade der gehinderten Diffusion bis zur y-Achse kann mit dem erhaltenen y-Wert die Verkapselungseffizienz errechnet werden. Um eine Aussage zur Austauschzeit und den Diffusionskoeffizienten machen zu können wird Experiment wird bei verschiedenen Diffusionszeiten Delta wiederholt.
Je länger die Diffusionszeit Delta dabei gewählt dabei wird, desto mehr Moleküle können in dieser Zeit die Kapselwand durchdringen.
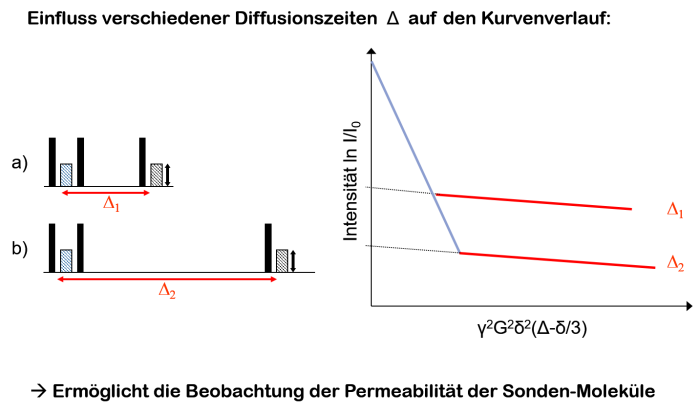
Es wandern also mehr Moleküle, die beim 1. Gradientenpuls in der Kapsel eingeschlossen waren durch die Kappselwand und befinden sich beim 2. Gradientenpuls im freien Medium und umgekehrt. Die daraus folgende Kurve liegt dann tiefer, da nun weniger Sonden-Moleküle beim 2. Gradientenpuls die gleiche Phasenverschiebung aufweisen. Man kann also sagen das bei steigender Diffusionszeit die „Konzentration“ an Tracer-Molekülen, die bei beiden Gradientenpulsen eingekappselt waren, geringer wird.
Bilder und Texte aus:
-
Linders, Jürgen;Untersuchung nanoskaliger Systeme mit Feldgradienten NMR : Von Amphiphilen bis zur NanokapselDuisburg, Essen (2014) 226 S. : graph. Darst.
