Wissenschaft: AG Immunologie Sepsis/Trauma
Reprogrammierung von DCs während polymikrobieller Sepsis
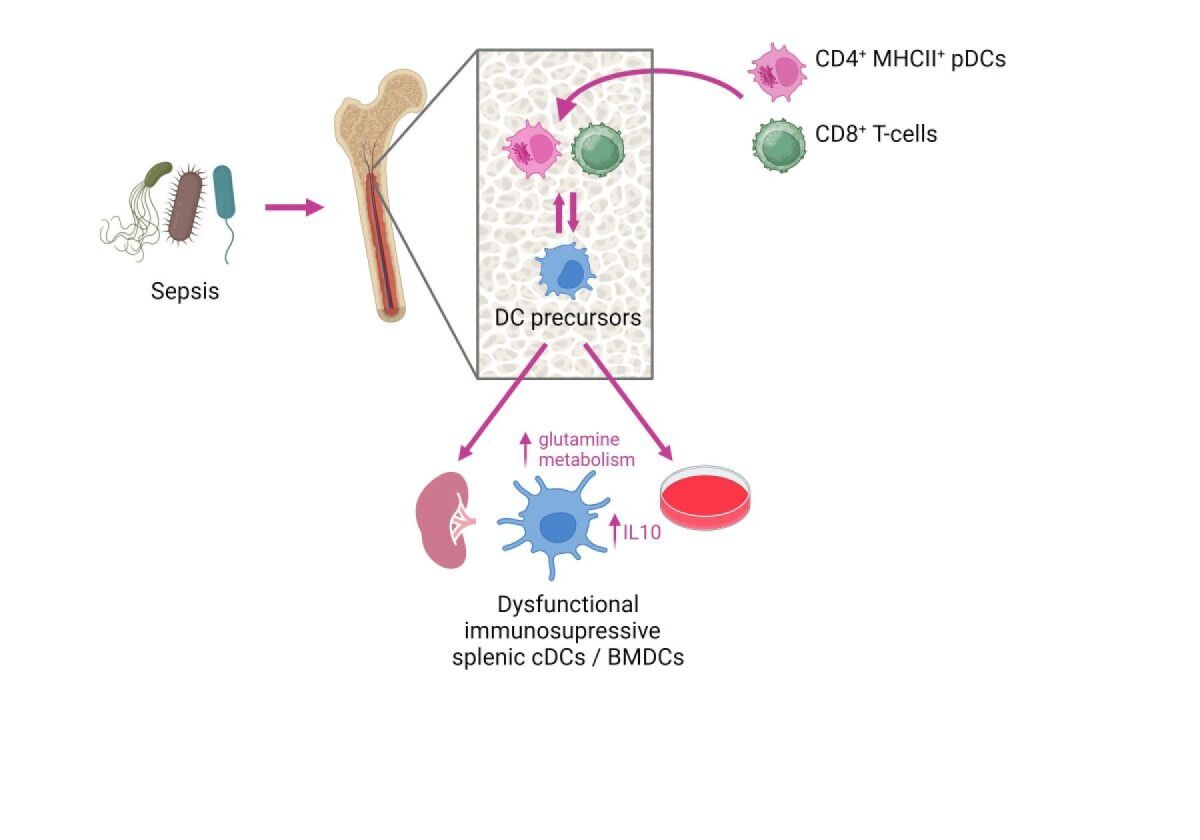
Dendritische Zellen (DCs) koordinieren die angeborenen und adaptiven Immunantworten gegen Krankheitserreger und tragen wesentlich zur sepsisbedingten Immunsuppression bei. Anhand eines klinisch relevanten Sepsismodells haben wir gezeigt, dass Sepsis eine lang anhaltende Wirkung auf DC-Vorläuferzellen ausübt und deren Differenzierung im Knochenmark moduliert. Dies führt zur Entwicklung von DCs mit einem immunsuppressiven Phänotyp, der sich in einer erhöhten Produktion des entzündungshemmenden Zytokins IL-10 und einer Hemmung der schützenden Th1-Immunantwort widerspiegelt (Flohé SB et al J Leukoc Biol 2006). Darüber hinaus beeinträchtigen neu gebildete DCs aus dem Knochenmark direkt die Immunabwehr gegen P. aeruginosa, eine häufige Ursache von nosokomialen Infektionen in der Lunge (Pastille E J Immunol 2011).
Auf der Suche nach den Mechanismen, die der Modulation der DC-Differenzierung zugrunde liegen, haben wir mehrere Zellpopulationen identifiziert, die zu einer Umprogrammierung von DC-Vorläufern beizutragen scheinen, wie z. B. aktivierte CD4+ MHCII+ plasmazytoide DCs (Smirnov A, Front Immunol 2017) und CD8+ T-Zellen (Antoni A-C, Front Immunol 2022). Darüber hinaus ist die funktionelle Umprogrammierung von DCs während der Sepsis mit einem veränderten Glutamin-Stoffwechsel verbunden, dessen Ursprung bisher unbekannt ist.
Unsere laufenden Arbeiten konzentrieren sich auf die molekularen Mechanismen, die für die lang anhaltende Modulation von DC-Vorläufern bei Sepsis verantwortlich sind. Die Wiederherstellung der DC-Funktion könnte neue Ziele für die Entwicklung einer Immuntherapie bei Sepsis darstellen.
Ursprung der NK-Zell-Dysfunktion bei steriler Entzündung und Sepsis
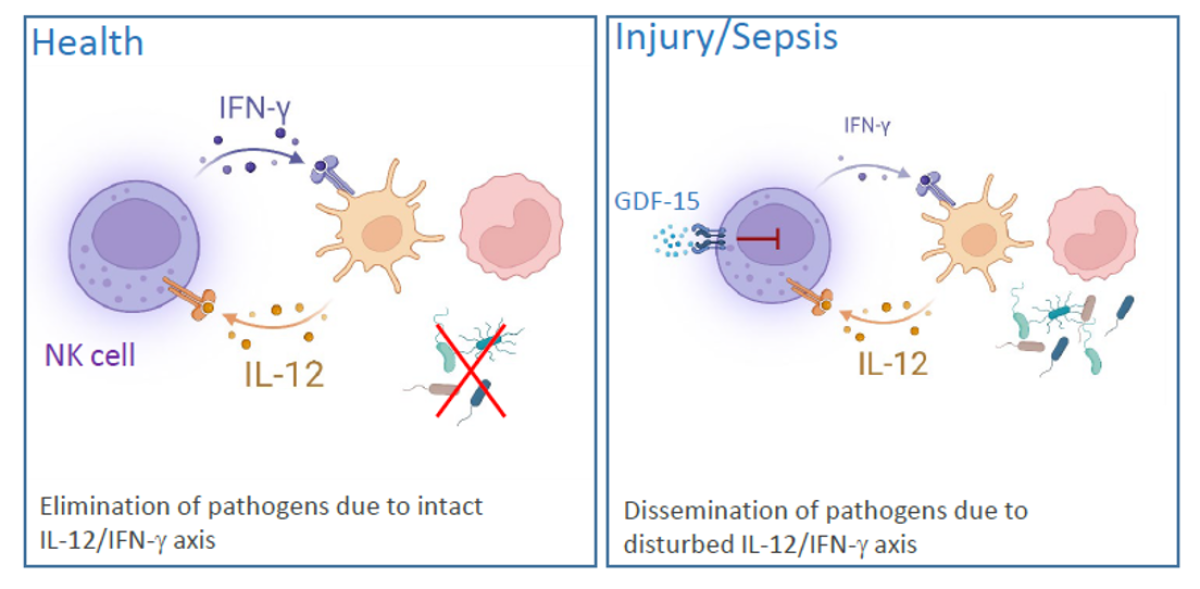
Dendritische Zellen (DCs), die in fast allen Geweben vorkommen, erkennen eindringende Krankheitserreger und sezernieren verschiedene Zytokine und Chemokine, die weitere Immunzellen rekrutieren und aktivieren. Interleukin (IL) 12, das von DCs während einer Infektion freigesetzt wird, aktiviert natürliche Killerzellen (NK). Als Reaktion auf IL-12 produzieren NK-Zellen IFN-γ, das die Eliminierung von Krankheitserregern durch Makrophagen und Neutrophile unterstützt. Unsere früheren Arbeiten haben gezeigt, dass die IFN-γ-Synthese von NK-Zellen innerhalb von 24 Stunden nach einer schweren traumatischen Verletzung fast vollständig beeinträchtigt ist. Die Hemmung der NK-Zellen ist lang anhaltend und zeigt sich noch bei der Entlassung aus dem Krankenhaus, oft Monate nach der Verletzung. Wir haben eine gestörte IL-12/IFN-γ-Achse in den NK-Zellen der Patienten identifiziert, die durch den zirkulierenden Wachstums-/Differenzierungsfaktor (GDF) 15 und die endogene Reprogrammierung der Zellfunktion vermittelt wird (Kleinertz et al 2019, EBioMedicine 43:380). Tder Grad der NK-Zell-Dysfunktion hängt mit der Schwere der Gewebeschädigung zusammen (Müller et al. 2021, Life 12:13.) und ist mit Veränderungen im Zellstoffwechsel verbunden.
Anhand eines Modells für polymikrobielle Sepsis fanden wir Hinweise auf eine gestörte Interaktion von DCs und NK-Zellen in der Lunge (Pastille et al. 2015 Innate Immun. 21:115-26) was darauf hindeutet, dass die NK-Zell-Dysfunktion nicht auf sterile systemische Entzündungen beschränkt ist, sondern auch bei systemischen Infektionen auftritt. Die aktuelle Arbeit konzentriert sich auf die molekularen Mechanismen, die der gestörten IL-12/IFN-γ-Achse zugrunde liegen und die therapeutische Ziele zur Wiederherstellung der Funktion von NK-Zellen darstellen könnten.