Immunologie
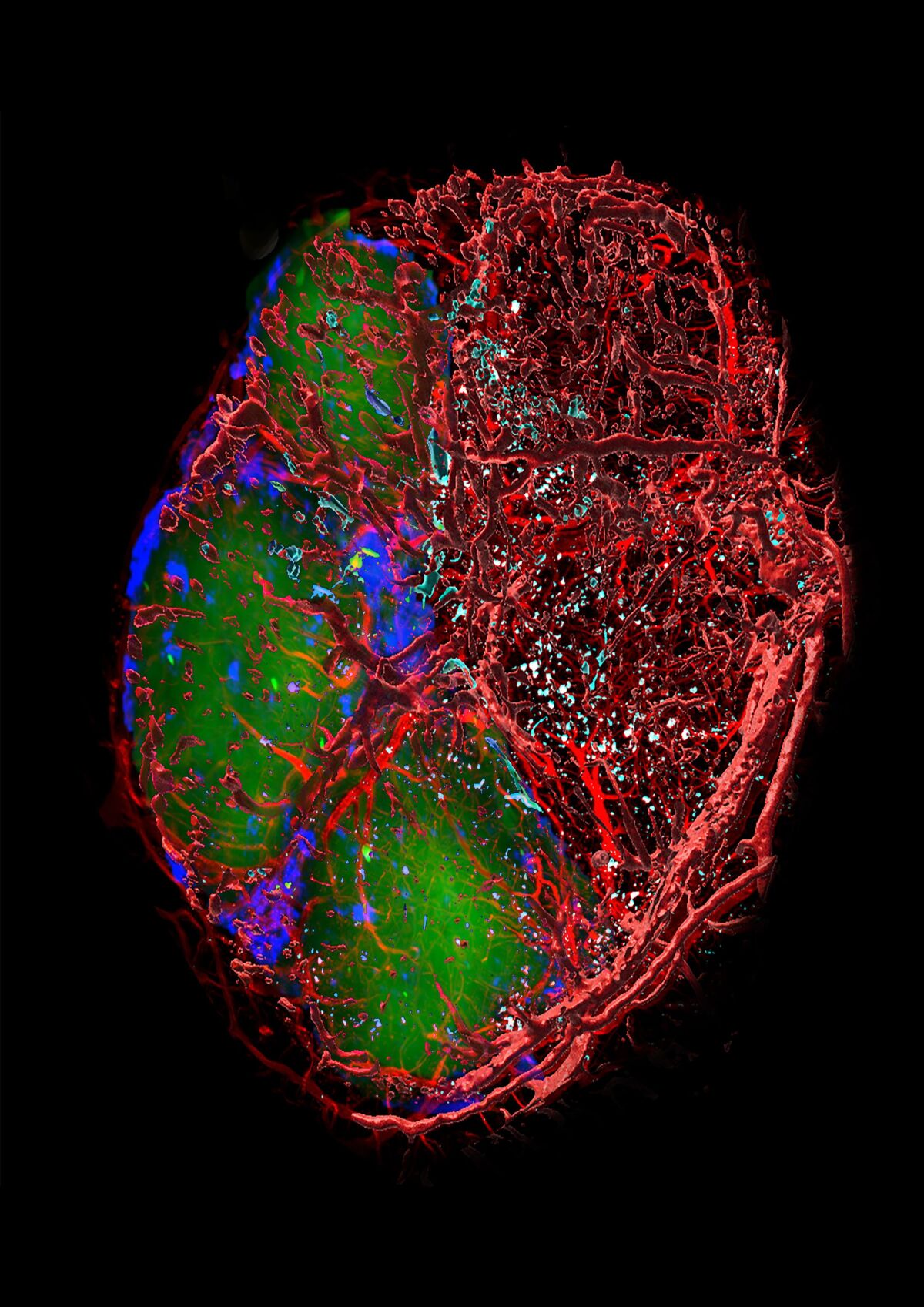
Das Bild zeigt ein isoliertes Peyer Plaque (PP, eine Art Lymphknoten im Darm) aus dem Darm einer Maus nach einem Schlaganfall. Zu sehen sind Ansammlungen von zwei verschiedene Immunzelltypen (B Zellen in grün, T Zellen in dunkelblau) sowie das Blutgefäßnetzwerk, das die Struktur durchzieht (rot). In türkis angefärbt sind Mikrothromben, die in den Gefäßen liegen und die Blutversorgung des PP stören. Nach einem Schlaganfall entstehen solche Mikrothromben regelmäßig. Durch die gestörte Blutversorgung kommt es zum Absterben der B- und T-Zellen und als Folge davon zu einem Verlust an immunologischer Abwehrkraft. Dies gilt für Mäuse, aber genauso auch für Menschen. In unserer Arbeit haben wir diesen Mechanismus aufgeklärt und gleichzeitig auch eine Therapie gefunden, die die Bildung der Mikrothromben und damit auch den Verlust der Immunabwehr bei Mäusen und Menschen komplett verhindert.
Untersuchung der Ursachen von Immunschwäche bei Schlaganfall
Jedes Jahr erleiden weltweit etwa 15 Millionen Menschen einen Schlaganfall. Das Post-Schlaganfall-Immunschwächesyndrom verursacht bei den Patienten schwere bakterielle Infektionen und verschlechtert den Krankheitsverlauf. Atemwegs- und Harnwegsinfektionen nach einem Schlaganfall sind mögliche Ursachen für längere Krankenhausaufenthalte und eine höhere Sterblichkeit. Die zellulären Mechanismen der Immunschwäche nach einem Schlaganfall und mögliche Behandlungsstrategien sind jedoch noch nicht bekannt. In unserer Studie untersuchten wir diese unbekannten Prozesse der Immunsuppression und schlugen mögliche Optionen für die Behandlung vor.
Untersuchung des Verlusts von Lymphozyten und Immunglobulin A bei Mäusen nach einem Schlaganfall
In unserem experimentellen Mausmodell des Schlaganfalls untersuchten wir die Marker der Immunsuppression, die bei Schlaganfallpatienten häufig vorhanden sind, nämlich den Verlust von Lymphozyten und Immunglobulinen. Dazu wurde bei Mäusen experimentell eine Hirnischämie herbeigeführt, die die Situation eines menschlichen Schlaganfalls sehr gut nachahmt. Alle Eingriffe an Mäusen wurden unter tiefer Narkose und schmerzhemmenden Analgetika durchgeführt, um potentielles Leiden zu minimieren. Der Grad der Hirnschädigung, der Immunsuppression und der bakteriellen Lungeninfektionen wurde zu verschiedenen Zeitpunkten nach dem Schlaganfall mit verschiedenen Forschungsmethoden untersucht. Nach dem Schlaganfall wurden die Mäuse schmerzfrei getötet, und verschiedene Gewebe für die Analyse aufbereitet.
Die Immunschwäche, Infektionen nach dem Schlaganfall sowie neue therapeutische Konzepte wurden anhand verschiedener Parameter untersucht:
1. Analyse des Immunglobulin-A-Spiegels im Blut.
2. Quantifizierung der Lymphozytenzahlen in verschiedenen Immunorganen.
3. Bakterienlast in infizierten Lungenflügeln.
4. Messung der Neutrophil Extracellular Traps (NETs) im Blut als Auslöser des Lymphozyten-Todes.
5. Erprobung von NET-Inhibitoren als möglicher therapeutischer Ansatz.
In unserer Studie fanden wir heraus, dass die Freisetzung von NETs ein starkes systemisches Signal nach einem Schlaganfall ist, das ein massives Absterben von Lymphozyten auslöst und die Menge der Immunglobuline im Blut verringert. Sowohl der Abbau von NETs durch das Enzym DNase-I als auch die Blockierung der NET-Bildungswege durch das experimentelle Medikament LDC7559 halfen, Immunschwäche und bakterielle Infektionen nach dem Schlaganfall zu hemmen. Wichtig ist, dass wir 100 % der Ergebnisse, die wir bei Mäusen fanden, auch bei menschlichen Patienten bestätigen konnten. Dies gilt auch für die DNase-I-Therapie, die wir auf der Grundlage unserer präklinischen Studie in einer kleinen Kohorte von Schlaganfallpatienten erfolgreich bestätigen konnten. Die therapeutische Erprobung von DNase-1 befindet sich derzeit in klinischen Phase-1-Studien, wobei der Schwerpunkt auf neurologischen Vorteilen liegt, aber unsere neuen Ergebnisse könnten ihre Wirkung auf die Verringerung von Immunschwäche und Infektionen bei Patienten nach einem Schlaganfall ausdehnen. Ein Test von LDC7559 am Menschen ist in Vorbereitung.
Ali A. Tuz et al. Stroke and myocardial infarction induce neutrophil extracellular trap release disrupting lymphoid organ structure and immunoglobulin secretion. Nature Cardiovascular Research, volume 3, pages 525–540 (2024). DOI: 10.1038/s44161-024-00462-8